Os tumores intracranianos podem ser originados de tumores que nasceram em outros órgãos do corpo (e aí são denominados de metástases cerebrais), ou são oriundos do próprio espaço intracraniano, seja das meninges, das células nervosas, ou das células de suporte do cérebro. Veremos cada um desses tipos. A incidência de tumores intracranianos é relativamente rara, são 23 casos a cada 100.000 habitantes por ano. Felizmente, os benignos respondem pela maioria, 69%, ou 16 a cada 100.000 habitantes por ano. Os malignos são somente 7 para cada 100.000 habitantes, o que representa 32% do total.
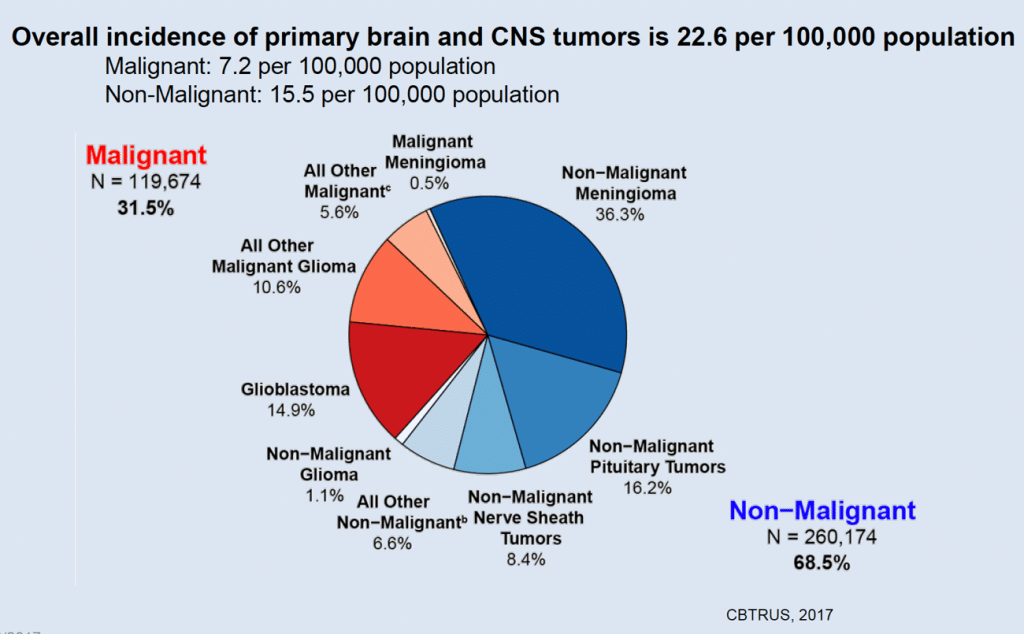
Entre todos, as metástases são os tumores mais prevalentes (mais comumente encontrados), respondendo por cerca de 50% dos casos. Os gliomas (entre os tumores próprios do cérebro), perfazem 30-35% dos casos, e os meningiomas (originários das meninges de revestimento), 10% dos casos.
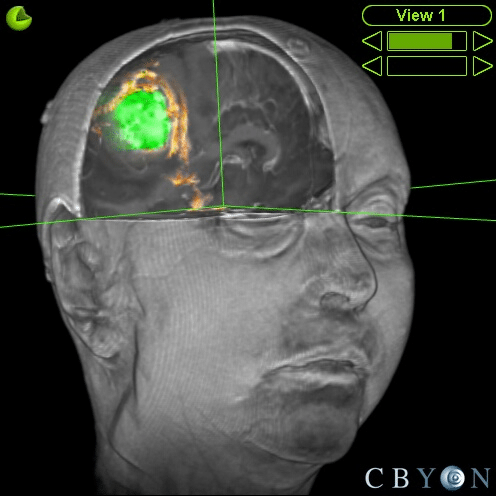
Exemplo de um tumor cerebral (verde) e sua relação com vias de controle dos movimentos (em dourado).
Gliomas (Tumor cerebral maligno)
Os tumores próprios do cérebro mais comuns são os gliomas ou astrocitomas. São divididos pela Organização Mundial de Saúde em 4 graus: grau 1, ou astrocitoma pilocítico, é de caráter benigno, o grau 2, ou astrocitoma difuso, é de baixo grau de malignidade, o grau 3 é também denominado astrocitoma anaplásico, e já possui um grau de agressividade maior; o grau 4 é o chamado astrocitoma grau 4 ou glioblastoma, a depender de uma mutação específica (IDH-1), esse último com maior de agressividade.
É uma pergunta frequente dos pacientes porque esses tumores nascem. Em uma publicação recente, nosso grupo defendeu a teoria de que esses tumores se formam a partir de uma maturação anômala de células-tronco encontradas normalmente dentro de nossos cérebros, mesmo na vida adulta. Por mecanismos ainda pouco conhecidos, essas células, ao invés de pararem de se multiplicar e se amadurecerem no cérebro, formando suas células maduras normais, entrariam num ciclo de proliferação, formando as chamadas células-tronco tumorais, que crescem sem controle. Essas células são cruciais do ponto de vista do tratamento, pois são células mais resistentes aos esquemas convencionais de quimioterapia e radioterapia.
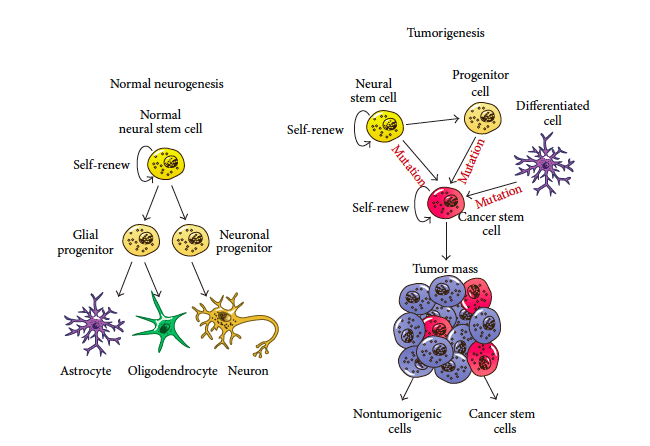
Teoria de formação de um tumor glial (Batista, Lepski e cols., 2015).
Diagnóstico
O diagnóstico dos gliomas se baseava até pouco tempo no padrão de apresentação às lâminas de histologia, coradas de maneira padronizada (hematoxilina-eosina). Na revisão mais recente da classificação internacional de tumores cerebrais da Organização Mundial de Saúde, OMS, de 2016, no entanto, foram acrescidos aspectos genéticos para se caracterizar o tipo de tumor. Esses marcadores são importantes para se estimar o comportamento do tumor (mais ou menos agressivo) e, mais importantemente, para se orientar uma terapia mais racional, eficaz (terapia-alvo, vide adiante).
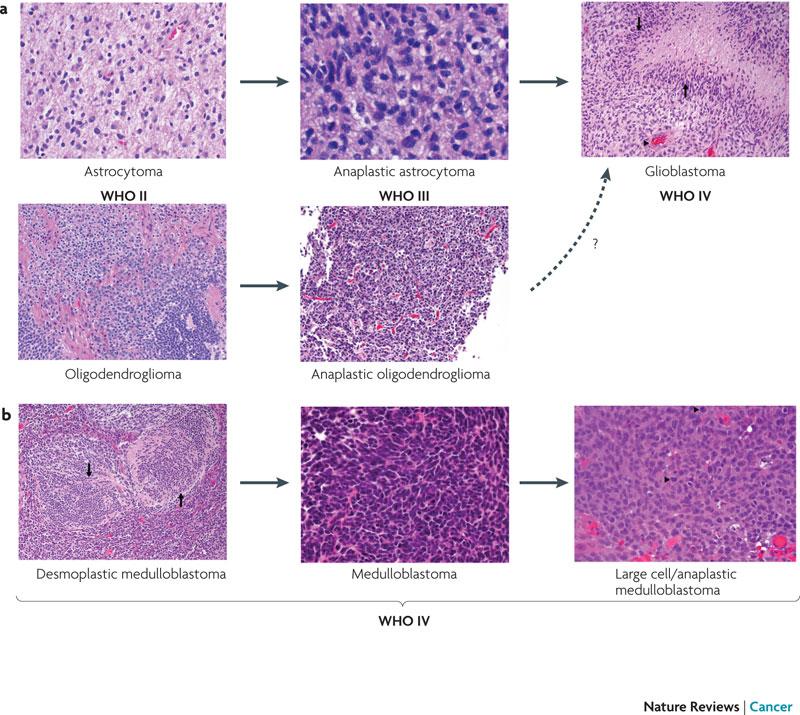
Classificação dos tumores gliais de acordo com seu tipo histológico. Uma publicação de nosso grupo propõe avanços no diagnóstico imunohistoquímico desses tumores, com a finalidade de uma classificação mais correta e tratamento mais preciso. Leia a publicação de nosso grupo.
Tratamento
O tratamento clássico combina três etapas:
- Cirurgia – visa remover o máximo possível do tumor, preservando as funções cerebrais.
- Radioterapia – utiliza feixes de radiação para destruir células tumorais remanescentes.
- Quimioterapia com temozolomida – medicamento em comprimido, usado durante e após a radioterapia, que interfere no DNA das células tumorais, levando-as à morte.
- Terapias–alvo – baseado em medicamentos que atacam vias metabólicas específicas que o tumor usa para sobreviver
- Imunoterapia celular- nova modalidade de tratamento que visa fortalecer a reação imunológica que todos apresentamos contra células tumorais
Cirurgia
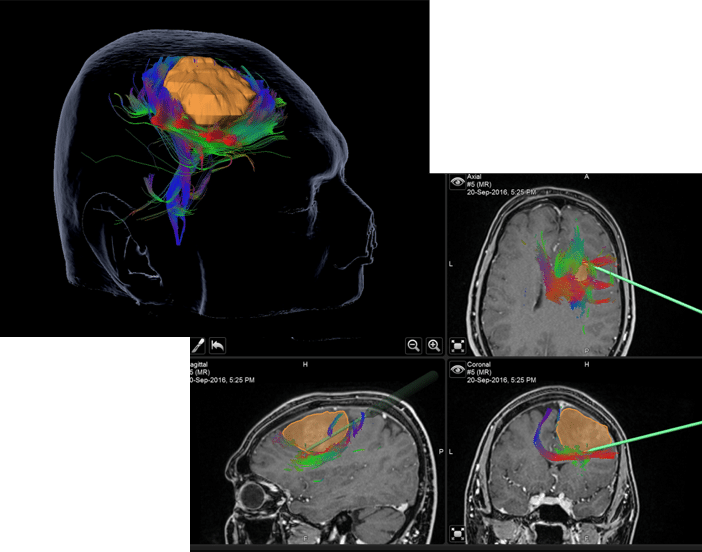
Exemplo de uma cirurgia de um glioma em região frontal, onde se fez a cirurgia orientada por mapeamento cerebral das principais vias de conexão neural e mapeamento da atenção e cálculo.
Veja reportagem do Fantástico a respeito desse caso operado com auxílio de mapeamento cerebral:
O tratamento inicial dos gliomas é a cirurgia, para se permitir o alívio da pressão dentro do crânio e se permitir a análise patológica/molecular do tecido tumoral. Objetiva-se com o tratamento cirúrgico a ressecção da maior quantidade tumoral possível, sem que haja piora do quadro neurológico do paciente. Para tanto, lançamos frequentemente mão de recursos avançados de imagem cerebral, para se mapear funções neurológicas relevantes como a fala, a motricidade, a visão, bem como as vias neurais de conectividade entre essas áreas. Adicionalmente, realizamos pré-operatoriamente mapeamento não-invasivo dessas funções, para se estudar as áreas cerebrais ditas críticas (cujas funções não podem ser “aprendidas” por áreas vizinhas. Durante a cirurgia, essas imagens são integradas num sistema computacional, para orientarem, guiarem o cirurgião para uma ressecção segura. Modernos centros de cirurgia oncológica dispõe de sistema integrado para demonstração dessas imagens em tempo real, bem como permitem a realização de ressonância magnética durante o ato cirúrgico. Complementarmente, a monitorização dessas funções cerebrais por meio de estimulação elétrica durante a cirurgia permite se poupar áreas críticas, permitindo assim uma ressecção máxima do tumor, com preservação do estado funcional do paciente e melhora de sua qualidade de vida. Está relativamente bem estabelecido que para os tumores malignos, de graus II a IV, o grau de ressecção do tumor correlaciona-se positivamente com a sobrevida do paciente. Além do exposto, outros recursos podem ser usados durante a cirurgia, para se ampliar a ressecção. São esses a marcação do tumor com uma substância fluorescente, o Gliolan, (que torna o tumor brilhante, “saltando aos olhos” do cirurgião), e esponjas embebidas com quimioterápico, que podem ser aplicadas na cavidade do tumor, permitindo assim uma quimioterapia local mais efetiva (Gliadel). Esses recursos aumentam a eficácia da cirurgia.
Para a maioria cirurgias de tumor cerebral, é essencial o mapeamento adequado das funções cerebrais a fim de se preservar a função, além de se ressecar a maior parte possível da lesão, idealmente de maneira total.
Veja publicações nossas a respeito:
Intraoperative assistive technologies and extent of resection in glioma surgery
Radioterapia
Os tumores de graus II a IV são complementarmente tratados por meio de radioterapia após a ressecção cirúrgica. A dose varia, mas usualmente é de 6,5 Gy dividido ao longo de 30 sessões diárias. Em máquinas modernas de radioterapia, pode-se fazer o planejamento tridimensional da lesão (IMRT), poupando-se mais tecido cerebral saudável de doses excessivas de radiação, o que contribui para uma menor ocorrência de efeitos colaterais secundários ao tratamento.
Eventualmente, protocolos de irradiação mais abreviados podem estar indicados para pacientes idosos ou em condições específicas, a fim de se diminuir o tempo de tratamento.
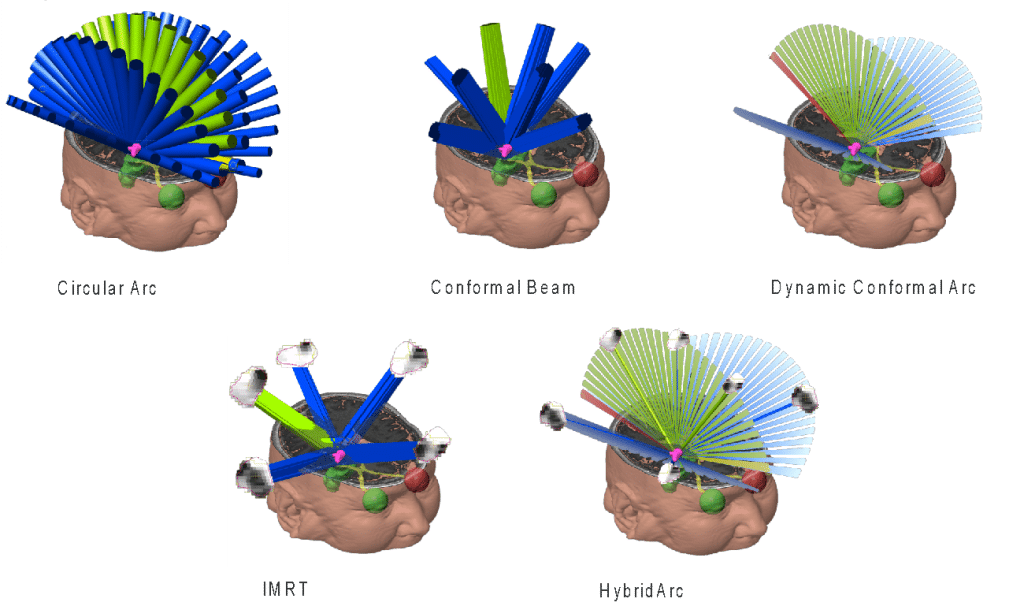
Exemplos de modos de tratamento de um tumor cerebral por meio de aplicação de radiação. Um maior número de feixes de irradiação, em angulações diferentes, permite se poupar o tecido circunvizinho ao tumor de doses excessivas de radiação.
Quimioterapia
A temozolomida (TMZ) continua sendo a base do tratamento porque é eficaz e atravessa bem a barreira hematoencefálica (a proteção natural do cérebro). Seu sucesso depende de um gene chamado MGMT: quando ele está “silenciado” (metilado), o tumor tende a responder melhor.
Em uma publicação importante de nosso grupo com parceiros alemães, estabelecemos de maneira pioneira o tempo ideal de tratamento com Temodal a fim de se garantir melhores resultados. Leia nossa publicação a respeito.
Terapias-alvo
Nos últimos anos, o foco da pesquisa tem sido identificar mutações genéticas específicas que possam ser atacadas de maneira precisa, poupando o tecido cerebral saudável. Essa é a essência das terapias-alvo.
Entre os principais avanços estão:
- Inibidores de IDH1 e IDH2: muitos gliomas de baixo grau apresentam mutações nesses genes. Novos medicamentos, como ivosidenib e vorasidenib, bloqueiam essas enzimas anormais, retardando o crescimento do tumor. O vorasidenib, em especial, mostrou resultados promissores em ensaios clínicos de 2023 e 2024.
- Terapias contra EGFR e outras vias de crescimento celular: alguns glioblastomas apresentam mutações no gene EGFR, responsável por estimular a multiplicação celular. Novas drogas e anticorpos monoclonais tentam bloquear essa via, como depatalimab e nimotuzumab, embora ainda em fase experimental.
- Inibidores de angiogênese (anti-VEGF): o bevacizumabe é um anticorpo que impede a formação de novos vasos sanguíneos que alimentam o tumor. Ele ajuda a controlar o inchaço cerebral e melhora sintomas, embora não aumente significativamente a sobrevida em todos os casos.
Terapias combinadas e futuras perspectivas
Recentemente, a inteligência artificial e a análise genômica têm ajudado a identificar quais pacientes se beneficiam mais de cada tratamento — um passo rumo à oncologia personalizada.
Muito se tem avançado no tratamento de gliomas, e a tendência atual é combinar terapias, integrando quimioterapia, imunoterapia e terapia-alvo. Pesquisas recentes lideradas por nosso grupo estudam vacinas personalizadas, como vacinas de células dendríticas, que estimulam o sistema imunológico a reconhecer o tumor de maneira mais eficiente, impedindo seu crescimento mas causando sua diminuição ou até desaparecimento. Trata-se de um dos mais promissores avanços no tratametno de gliomas, de repercussão internacional.
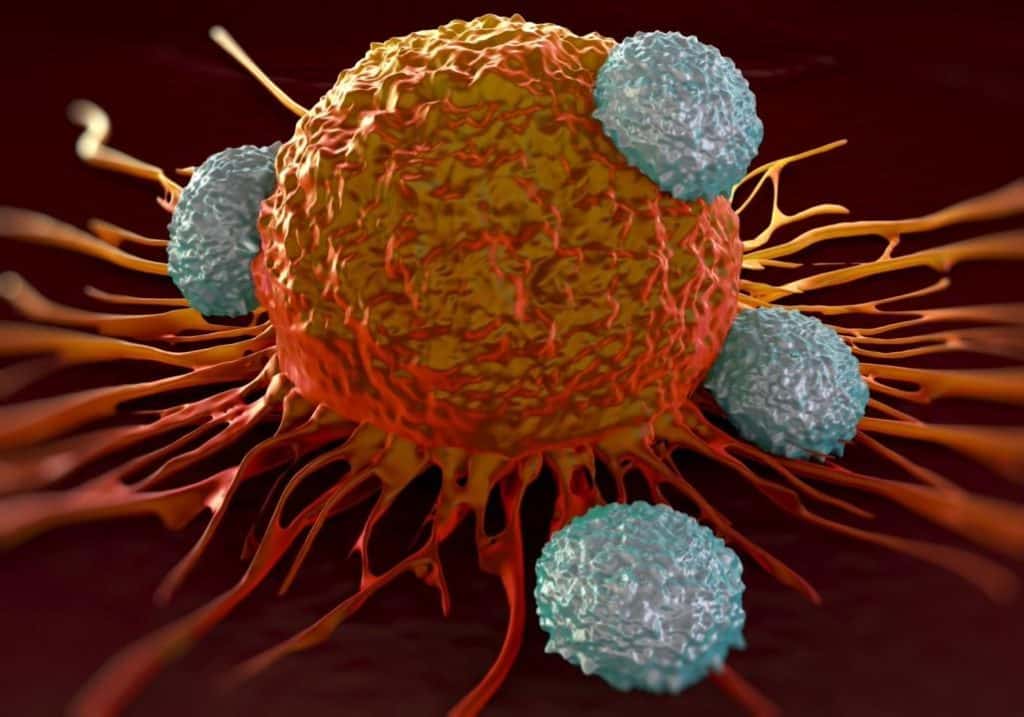
A célula dendrítica é uma célula que coordena a reação imunológica de defesa contra agentes externos, o que inclui células tumorais.
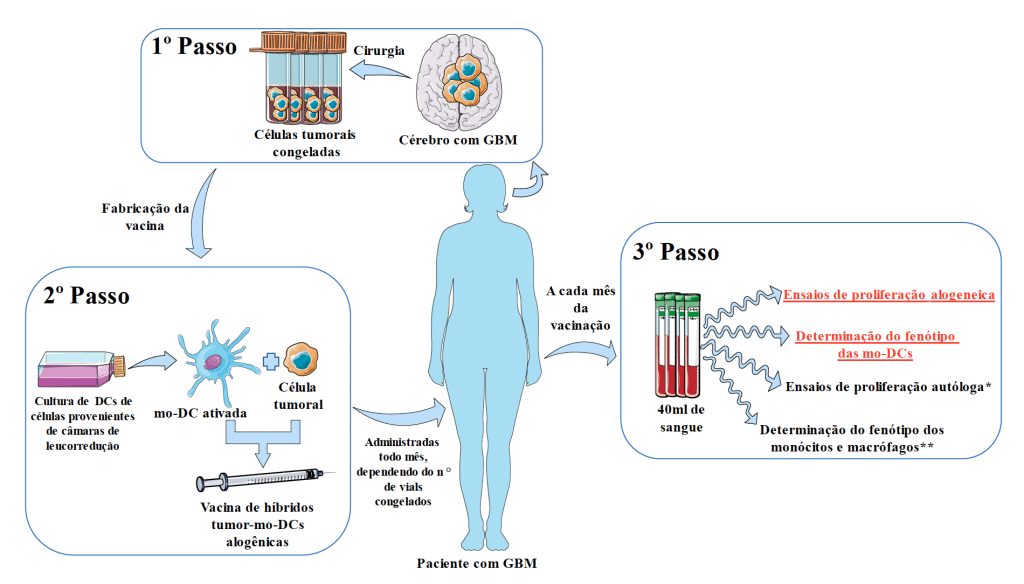
Em protocolo desenvolvido por nosso grupo de pesquisa, as células dendríticas de doadores normais são fundidas com células vivas de tumores cerebrais extraídas durante a cirurgia; depois de purificadas e irradiadas, as células são implantadas por via intra-cutânea nos pacientes com tumores cerebrais, a intervalo mensal, em consultório (sem necessidade de internação).
No ano de 2024, nosso estudo de fase 2 foi publicado Vide publicações abaixo. De um modo geral, reportamos aumento de sobrevida de 75% para glioblastoma e 200% (sobrevida triplicada) em astrocitoma grau 4- vide publicação de número 3 abaixo. Adicionalmente, definimos o perfil imunológico dos pacientes respondedores à terapia vacinal (publicação 2), e ainda reportamos sobrevida tardia em 19% dos pacientes vacinados, com excelente qualidade de vida (vide publicação 1 abaixo).
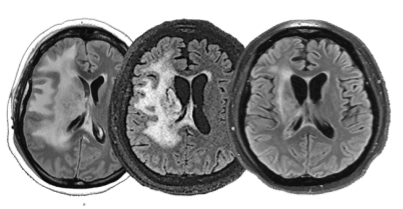
Ressonância de paciente com glioblastoma (área branca do lado esquerdo da imagem), que remitiu ao longo de 4 meses sob terapia vacinal (reportado na publicação de número 4 acima). Para mais detalhes sobre essa terapia, assista aula no nosso canal no youtube: video-aula.

